Ткаченко Е. И., Орешко Л. С., Ситкин С. И., Соловьева Е. А., Шабанова А. А., Журавлева М. С. Северо-Западный государственный медицинский университет им. И. И. Мечникова, Санкт-Петербург, Россия
Ткаченко Евгений Иванович — доктор медицинских наук, профессор, заведующий кафедрой кафедры пропедевтики внутренних болезней Северо-Западного государственного медицинского университета им. И. И. Мечникова (СЗГМУ им. И. И. Мечникова),
Орешко Людмила Саварбековна — доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней Северо-Западного государственного медицинского университета им. И. И. Мечникова (СЗГМУ им. И. И. Мечникова),
Ситкин Станислав Игоревич — кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней Северо-Западного государственного медицинского университета им. И. И. Мечникова (СЗГМУ им. И. И. Мечникова),
Соловьева Елена Анатольевна — очный аспирант 2 года обучения кафедры пропедевтики внутренних болезней Северо-Западного государственного медицинского университета им. И. И. Мечникова (СЗГМУ им. И. И. Мечникова),
Шабанова Анна Александровна — ассистент кафедры пропедевтики внутренних болезней Северо-Западного государственного медицинского университета им. И. И. Мечникова (СЗГМУ им. И. И. Мечникова)
Материал и методы.
В исследование были включены 20 больных целиакией с преобладанием запора и наличием признаков метаболических расстройств. Возраст пациентов составил 31,8 ± 9,5 лет, соотношение мужчин и женщин — 1:5,3. Диагноз целиакии устанавливали на основании клинико-анамнестических данных, эндоскопического исследования, гистоморфологических изменений биопсийного материала слизистой оболочки двенадцатиперстной кишки, генетического исследования крови (HLA-DQ2 и HLA-DQ8). Все больные получали Фукус-желе «Натив-комплекс» в течение 2 месяцев
Результаты..
При оценке консистенции стула у 45 % пациентов отмечался 1-й тип стула, у 40 % пациентов — 2-й тип и у 15 % пациентов — 3-й тип стула согласно Бристольской шкале. По результатам биоимпедансометрии установлено, что у 15 больных (75 %) отмечалось значимое снижение жировой массы и у 13 больных (65 %) — безжировой массы. Общее бактериальное число у всех пациентов было ниже референтного значения, а количество представителей условно-патогенной флоры, грибов и вирусов в составе фекальной микробиоты было значимо увеличено.
После проведенного курса дополнительного питания у пациентов отмечалась статистически значимая положительная динамика субъективных расстройств. Наблюдалась нормализация околосуточного кишечного ритма у больных, получавших дополнительное питание. В конце исследования 70 % пациентов имели стул каждый день, 30 % пациентов — через день. Средняя частота стула составила 5,95±1,80 раз в неделю. У 80,0 % пациентов стул соответствовал 4-му и 5-му типам по Бристольской шкале, у 20,0 % пациентов наблюдался 3й тип стула. Отмечалось улучшение количественного и качественного состава микробиоты.
Заключение..
Длительное соблюдение безглютеновой диеты больными целиакией приводит к снижению потребления пищевых волокон и полисахаридов, что способствует развитию дисбиоза кишечника. Назначение больным целиакией дополнительного функционального питания приводит к купированию симптомов желудочной и кишечной диспепсии, нормализации консистенции и частоты стула и улучшению профиля микробиоты кишечника.
Ключевые слова: безглютеновая диета, дисбиоз кишечника, метаболические расстройства, функциональное питание, целиакия.
Введение
В структуре гастроэнтерологических заболеваний в последние годы наблюдается неуклонный рост генетического заболевания — целиакии. Это заболевание является генетически детерминированной мультифакториальной патологией, которая развивается при совокупном взаимодействии генетических факторов, представляющих полигенные системы, и средовых факторов. Одним из важных и патогенетически обусловленных средовых составляющих для данного заболевания являются злаковые культуры, в составе которыхсодержатся различные фракции белков пролами нов. Наиболее токсичным из них является альфа-глиадин, который обеспечивает устойчивость растительного белка к воздействию кишечных протеаз и расщеплению [6, 12].Многие авторы придерживаются мнения, что устойчивые пептидглютены оказывают токсическое воздействие на энтероциты и антигенное воздействие на иммунную систему слизистой оболочки тонкой кишки в результате неполного дезаминирования [2, 7, 12,16]. Нерасщепленные отдельные фракции белков злаковых культур вызывают патофизиологические изменения, проявляющиеся повышенной проницаемостью слизистой оболочки тонкой кишки, интегрированной иммунной реакцией и дисбиотическими нарушениями [1, 11]. Учитывая многообразие патологических изменений и атрофических процессов слизистой оболочки тонкой кишки, целиакия сопровождается нарушением мембранного пищеварения, всасывания нутриентов и моторики желудочно-кишечного тракта, что клинически проявляется метаболическими проявлениями, такими как сухость кожи, ломкость ногтей, выпадение волос [5, 14, 17]. Являясь мультифакториальным заболеванием, клинические проявления целиакии весьма разнообразны по направленности и обусловлены совокупностью комбинаций аллелей и полигенной системы [9, 13].
Принимая во внимание полиморфизм симптоматики, в клинической картине выделяют варианты течения с преобладанием диареи, констипации, внекишечных проявлений и их сочетание. Кроме того, заболевание может длительно протекать бессимптомно, и клиническая манифестация развивается поздно, в зрелом возрасте, с проявлениями симптомов желудочной и кишечной диспепсии и разнообразными внекишечными проявлениями.
В настоящее время целиакия взрослых встречается часто, болезнь принимает рецидивирующее течение с вовлечением в патологический процесс не только пищеварительной, но и эндокринной, дыхательной, скелетно-мышечной, нервной систем, а также кожи и ее придатков, что согласуется с данными литературы [3, 4, 7, 11]. Выделенные нами клинические варианты течения целиакии отражают все многообразие проявлений заболевания, а также ее бессимптомное течение.
Исходя из патогенеза, успешной патогенетической терапией остается на сегодня аглютеновое питание, которое уменьшает токсичность, антигенность, улучшает межконтактные связи энтероцитов. Питание, включающее злаковые культуры, является сбалансированным, так как содержит незаменимые аминокислоты, жирные кислоты, фосфолипиды, пищевые волокна, каротиноиды, микроэлементы и витамины группы В. Длительное исключение продуктов, содержащих глютен, у больных целиакией приводит к нарушению баланса питания, изменяя макро- и микроэлементный состав, дефициту пищевых волокон и, как следствие, вторичным дисбиотическим расстройствам [10, 14, 15, 16].
В связи с этим, для нормального функционирования организма больным целиакией необходимо питание, дополнительно включающее важные нутриенты, такие как витамины группы В, макрои микроэлементы, пищевые волокна. Решением этой проблемы явилось использование функционального питания на основе водорослей, содержащего инулин, флоротаннины, фукоиданы, альгинаты, минеральные вещества (йод, хром, селен, цинк, кремний).
Такое функциональное питание благодаря составу и технологии обработки веществ оказывает антисептическое, противовоспалительное, секретостимулирующее, метаболическое и прокинетическое действие, что способствует устранению патофизиологических изменений слизистой оболочки желудочно-кишечного тракта у больных целиакией. Необходимость совершенствования питания и лечения больных целиакией остается актуальной. В этой связи нам представляется оправданным дополнительное функциональное питание, включающее различные компоненты, направленные на устранение синдрома мальабсорбции на фоне патогенетической аглютеновой диеты.
Признание этих фактов может лечь в основу совершенствования патогенетической терапии целиакии.
Цель исследования: Оценка эффективности лечебно-профилактического питания для коррекции алиментарных нарушений микроэлементного статуса и нормализации двигательной активности пищеварительного тракта больных целиакией.
Материал и методы исследования
В исследование были включены 20 больных целиакией с преобладанием констипации и наличием признаков метаболических расстройств. Возраст пациентов составил 31,8±9,5 лет. Соотношение мужчин и женщин составило 1:5,3 соответственно.Диагноз «целиакия» устанавливали на основании клинико-анамнестических данных, эндоскопического исследования, гистоморфологических изменений биопсийного материала ДПК, генетического исследования крови — HLA-DQ2 и HLA-DQ8.
Всем пациентам проводился стандартизированный опрос, анализ крови на микроэлементный профиль на основные микроэлементы (Cu, Mg, Se, I, Zn) и Ca, анализ кала на дисбиоз с применением хроматографа-масспектрометра ГХ/МС Agilent, биоимпедансометрия, электрогастроэнтерография с помощью гастроэнтеромонитора и оценивались следующие показатели: относительная электрическая мощность (Pi/Ps,%) и коэффициент ритмичности (Kritm, ед.) натощак и после еды.
Все больные получали Фукус-желе функционального питания в течение 2-х месяцев. Способ применения и дозы: Фукус-желе назначают внутрь по 40 г 2 раза в сутки за 15–20 минут до еды в течение 2-х месяцев. Все исследования выполнены с информированного согласия пациентов и соответствуют этическим нормам Хельсинской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей» (2000 г.) и требованиям, изложенным в основных нормативных документах РФ по клиническим исследованиям.
Статистическая обработка данных
Статистическая обработка данных выполнялась с использованием программы STATISTICA 10.0 (США) и встроенных функций пакета EXCEL. Использованные статистические методы: представление средних значений: среднее арифметическое с указанием стандартного отклонения, медиана с указанием 25-го и 75-го процентилей, критерий Колмогорова-Смирнова, анализ описательных характеристик (среднего арифметического значения, медианы и моды, коэффициентов асимметрии и эксцесса) и построение гистограмм, парный критерий Стьюдента, парный критерий Вилкоксона; анализ доверительного интервала для разности относительных частот номинальных показателей до и после лечения.Результаты исследования
По результатам стандартизированного опроса все пациенты предъявляли жалобы на желудочную и кишечную диспепсию, и жалобы, обусловленные По результатам стандартизированного опроса все пациенты предъявляли жалобы на желудочную и кишечную диспепсию, и жалобы, обусловленные запоры, сопровождающиеся урчанием в животе, вздутием, абдоминальными болями. Наряду с вышеуказанными жалобами наблюдались с высокой частотой жалобы на сухость кожи, ломкость ногтей, раздражительность, слабость, снижение работоспособности, нарушение сна, головные боли, которые расценивались как признаки синдрома мальабсорбции.Рисунок 1.
Распределение субъективных расстройств.
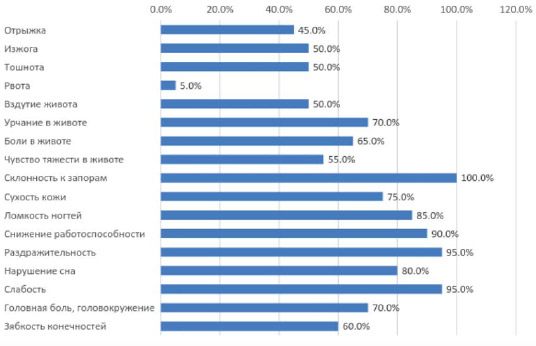
Частота стула у 75% пациентов составляла два раза в неделю, у 25% — 3 раза в неделю, в среднем
количество дефекаций составило 2,25±0,4, что являлось нарушением околосуточного ритма эвакуаторной функции кишечника, характерным для кишечной брадиаритмии.
При оценке консистенции стула у 45% пациентов отмечен 1-й тип стула, у 40% пациентов — 2-й тип стула и у 15% пациентов — 3-й тип стула согласно Бристольской шкале.
Анализ антропометрических данных показал, что у 13 (65%) пациентов были пониженные значения индекса массы тела (ИМТ) (менее 19,0 кг/ м2) и у 7 (35%) пациентов ИМТ имел нормальное значения и варьировал от 19,5 до 22,5 кг/м2. У большей части обследованных, наблюдались низкие значения толщины кожно-жировой складки (КЖСТ) (85,0%) и окружности плеча (ОП) (90,0%), что свидетельствовало о недостаточности питания (рисунок 2) [8].
Рисунок 2.
Распределение показателей антропометрии больных целиакией.
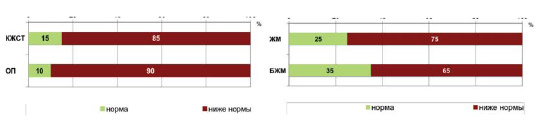
Рисунок 3.
Распределение показателей биоимпедансометрии больных целиакией.
По результатам биоимпедансометрии установлено, что у 15 больных отмечалось снижение значений жировой массы (ЖМ) (75,0%) и у 13 больных безжировой массы (БЖМ) (65,0%).
Таким образом, у больных целиакией выявлена недостаточность питания по типу алиментарного
маразма с дефицитом количества жировой ткани в организме и соматического пула белков вследствие мальабсорбции.
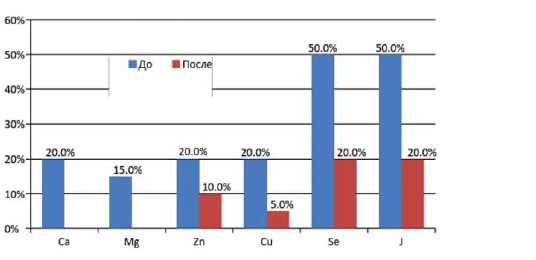
При изучении микроэлементного профиля крови у больных целиакией обнаружено снижение жизненно важных макро- и микроэлементов, таких как кальция, магния, цинка, меди, селена и йода, что свидетельствовало о недостаточном их поступлении в организм, обусловленным нарушением всасывания и несбалансированностью используемой аглютеновой диеты.
Изучение микробиоценоза у обследуемых методом газовой хроматографии-масспектрометрии показало, что дисбиотические изменения наблюдались у 100% обследуемых. По результатам исследования общая бактериальная масса пациентов была ниже референтного значения и составила более 200000 кл/г*105. Следует отметить, что нормальная флора составила 10,0%, условно-патогенная флора — 80,0%, грибы и вирусы — 10,0%. Особенностью кишечного микробиоценоза у обследованных явилось нарушение равновесности симбионтной флоры, которое проявлялось снижением содержания лактобактерий, бифидобактерий и бактероидов, что свидетельствовало о выраженности дисбиоза.
Приведенные данные исследования убедительно показали, что длительное соблюдение аглютеновой диеты больными целиакией приводит к снижению потребления пищевых волокон и полисахаридов, что способствует развитию дисбиотических расстройств, а именно снижению числа лактобактерий и бифидобактерий, продукции короткоцепочечных кислот, повышению роста энтеробактерий, также снижению макро — и микроэлементов в организме.
В связи с этим является оправданным назначение больным целиакией дополнительного функционального питания, включающего различные компоненты, направленные на устранение синдрома мальабсорбции, развившегося на фоне патогенетически обоснованной аглютеновой диеты.
После проведенного курса дополнительного питания у пациентов отмечалась статистически значимая положительная динамика субъективных расстройств (p<0,05). Наблюдалась нормализация околосуточного кишечного ритма у больных, получавших дополнительное питание. Так, 70% пациентов отмечали стул каждый день, 30% пациентов — через день. Средняя частота стула составила 5,95±1,8. У 80,0% пациентов отмечен 4-й и 5-й типы стула, у 20,0% пациентов — 3-й тип стула согласно Бристольской шкале.
Рисунок 4.
Динамика субъективных расстройств на фоне дополнительного питания.
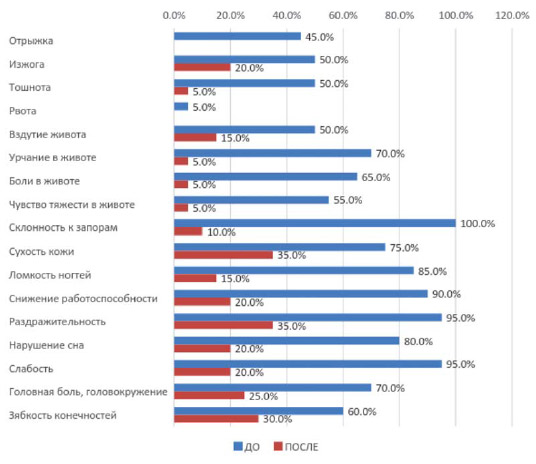
Рисунок 5.
Динамика показателей биоимпедансометрии, %.
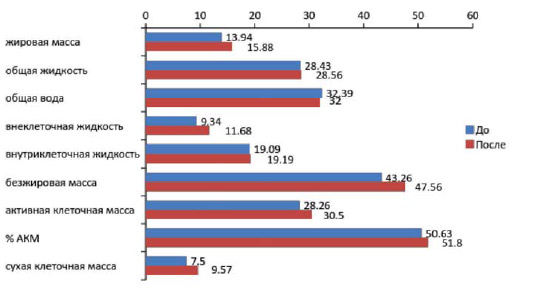
Рисунок 6.
Показатели микроэлементного профиля крови до и после приема дополнительного питания (изменение в% относительно исходного значения).
Как видно из рисунка 4, наблюдалась положительная динамика со снижением частоты предъявляемых субъективных расстройств (p< 0,05). Отмечена положительная динамика показателей нутриционного статуса пациентов, получавших дополнительное питание, что подтверждалось результатами биоимпедансометрии.
Следует отметить, что после проведения курса дополнительного питания у пациентов отмечалось увеличение безжировой массы и сухой клеточной массы (рисунок 5), что расценивалось как снижение признаков синдрома мальабсорбции на фоне сбалансированного функционального питания.
Наличие в составе функционального питания фукоиданов оказывает иммуномодулирующее действие и снижает воспалительный процесс слизистой оболочки желудочно-кишечного тракта.
Также, учитывая наличие в составе функционального питания альгинатов и инулина, обладающих прокинетическим действием, нормализуется пассаж кишечного содержимого, что положительно влияет на процессы переваривания и всасывания.
Что касается микроэлементного профиля крови, при сравнении показателей до и после приема функционального питания отмечалось повышение уровня микроэлементов, представленных на рисунке 5, однако у некоторой части больных показатели перечисленных микроэлементов не достигли нормального значения.
По результатам исследования показателей дисбиоза установлено, что после проводимого курса отмечается нормализация количественного и качественного состава микрофлоры у больных, которые проявляются в увеличении процентного содержания нормальной флоры (20,0%) и уменьшении условно-патогенной флоры (75,0%), грибов
и вирусов (5,0%).
После проведенного курса количественное содержание общей бактериальной массы увеличилось до значений более 350000 кл/г*105 (рисунок 7).
Изменение общей бактериальной массы, представленное на рисунке 8 происходило за счет повышения нормальной микрофлоры семейства лактобактерий и бифидобактерий (p< 0,05).
Рисунок 7.
Динамика показателей общей бактериальной массы, кл/г . 105.
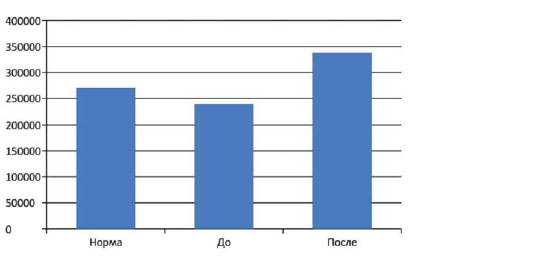
Рисунок 8.
Динамика количественных показателей нормальной кишечной флоры.
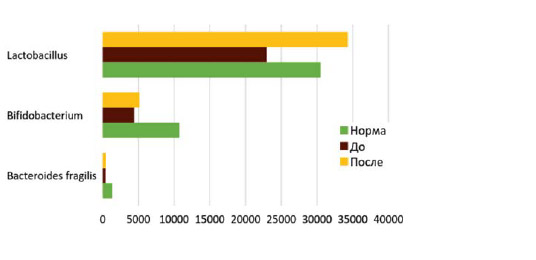
Рисунок 9.
Динамика показателей периферической ЭГЭГ фазу исследования натощак.
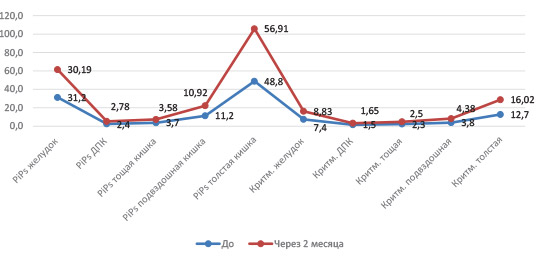
Рисунок 10.
Динамика показателей периферической ЭГЭГ в поспрандиальную фазу исследования.
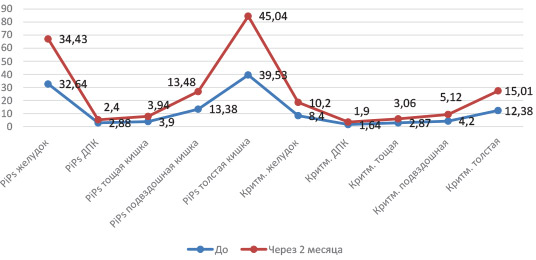
Объективной оценкой положительного влияния применения функционального питания на двигательную активность пищеварительного тракта явились результаты периферической ЭГЭГ. По данным периферической ЭГЭГ, показатели относительной мощности и коэффициента ритмичности отделов желудка, ДПК, тощей, подвздошной кишок варьировали в пределах нормальных значений, кроме показателей отдела толстой кишки.
После курса дополнительного функционального питания у пациентов отмечалось повышение показателей относительной мощности и коэффициента ритмичности на частоте толстой кишки в обе фазы исследования, что свидетельствовало о повышении тонической и пропульсивной активности данного отдела на фоне приема дополнительного питания за счет содержания альгинатов и инулина.
Таким образом, дополнительное функциональное питание на основе бурых водорослей, включающее альгинаты, фукоиданы, инулин и микроэлементы, у пациентов с целиакией, длительно соблюдающих аглютеновую диету, эффективно в целях уменьшения клинической симптоматики, нормализации двигательной активности пищеварительного тракта, клинически проявляющееся нормализацией частоты и консистенции стула.
Заключение
Дополнительное применения функционально го питания у больных целиакией, клиническая картина которых характеризовалась констипацией, в комплексной терапии оказалось эффективным для купирования симптомов желудочной и кишечной диспепсии, что подтверждалось статистически значимым снижением частоты субъективных расстройств после курса лечения (p<0,05). Наблюдалась положительная динамика консистенции стула: у большей части больных (80%) стул соответствовал 4–5 типу согласно Бристольской шкалы.При оценке показателей ПЭГЭГ после функционального питания выявлено повышение относительной мощности и коэффициента ритмичности на частоте толстой кишки в обе фазы исследования, что отражает нормализацию тонической и пропульсивной активности толстой кишки. Улучшение двигательной активности кишечника клинически проявлялось купированием констипаций у пациентов. Таким образом, функциональное питание, включающее альгинаты, фукоиданы, инулин и микроэлементы, у пациентов с целиакией на фоне аглютеновой диеты способствует нормализации двигательной активности пищеварительного тракта.
Учитывая комплексный состав, включающий макро- и микроэлементы, функциональное питание способствует сбалансированности нутриентного состава пищи.
Фукоиданы оказывают противовоспалительный эффект, тем самым положительно влияют на мембранное всасывание, уменьшая признаки мальабсорбции. По данным измерения состава тела средняя прибавка в массе тела за 2 месяца приема функционального питания составила 1,9 кг, что обусловлено восполнением дефицита нутриентного профиля и купированием синдрома мальабсорбции.
У пациентов на фоне приема исследуемого продукта отмечалось повышение общей бактериальная масса за счет представителей облигатной флоры (лактобактерий и бифидобактерий). Применение функционального питания показало эффективность у пациентов, имевших дефицит по уровню макро- и микроэлементов, таких как кальций, магний, цинк, селен, йод, мед, в виде нормализации микроэлементного профиля крови, которая приводит к уменьшению симптомов, таких как ломкость ногтей, сухость кожи, выпадение волос и снижение толерантности к физической нагрузке. Функциональное питание имеет хорошую переносимость, безопасен, может быть рекомендован для применения у пациентов с целиакией в качестве дополнения к патогенетической терапии для профилактики метаболических расстройств, связанных с длительным соблюдением АГД.
Схема лечения, которая может быть рекомендована для применения у пациентов с целиакией с преобладанием констипации: внутрь в течение 2 последовательных месяцев по 40 г 2 раза в день за 15–20 минут до еды, затем курсовой прием длительностью 4 недели каждые 6 месяцев.
Таким образом, лечебные мероприятия больным целиакией включают назначение функционального питания, обладающего противовоспалительным, прокинетическим, пребиотическим действием, способствует устранению клинических симптомов, признаков мальабсорбции, восполнению дефицита микроэлементного профиля и повышению пропульсивной и тонической активности желудочно-кишечного тракта, нормализующего суточный ритм кишечника.
PDF версия статьи из журнала:
PDF версия Физиология симбионтного и собственного пищеварения человека
Экспериментальная и клиническая гастроэнтерология 2015; 124 (12): 42–49
Functional nutrition is a critical component of treating metabolic disorders in celiac disease
Tkachenko Evgeniy Ivanovich — doctor of medicine, professor of the Department of Propedeutics of internal diseases of the St. Petersburg, North-Western State Medical University named after Mechnikov I. I.,
Oreshko Liudmila Savarbekovna — doctor of medicine, professor of the Department of Propedeutics of internal diseases of the St. Petersburg, North-Western State Medical University named after Mechnikov I. I.,
Sitkin Stanislav Igorevich — doctor of medicine, associated professor of the Department of Propedeutics of internal diseases of the St. Petersburg, North-Western State Medical University named after Mechnikov I. I.,
Solovieva Elena Anatolievna — full-time student 3 years of study of the Department of Propedeutics of internal diseases, St. Petersburg, North-Western State Medical University named after Mechnikov I. I.,
Shabanova Anna Aleksandrovna — assistant of the Department of Propedeutics of internal diseases, St. Petersburg, North-Western State Medical University named after Mechnikov I. I.
Summary Aim: To evaluate the eff ectiveness of Native-complex functional food to correct nutritional disorders and to normalize gastrointestinal motor activity in celiac disease (CD).
Methods: 20 CD patients with constipation and metabolic disorders were included in the study (age 31.8±9.5 years, male to female ratio 1:5.3). The diagnosis of CD was confi rmed by clinical and anamnestic data, endoscopy, histopathology of duodenal biopsy specimens, HLA-DQ2 and HLA-DQ8 typing. All patients received Native-complex Fucus jelly (Kelp jelly) within 2 months.
Results: At the beginning of the study 45% of patients had stools corresponding to the Bristol Stool Form Scale Type 1, 40% of patients had Type 2 stools and 15% of patient had Type 3 stools. 15 patients (75%) showed a decrease in fat mass and 13 patients (65%) showed a decrease in fat-free mass indicated by bioimpedance measurement. All patients had low values of total bacterial counts and increased abundance of pathobionts including fungi and viruses in fecal microbiota. Supplementary nutrition signifi cantly improved symptoms, intestinal circadian rhythms and stool consistency in CD patients. At the end of the study 70% of patients had daily bowel movements, 30% of patients had stools every other day. The average stool frequency was 5,95 ± 1,80 per week. 80% of patients had Type 4 or Type 5 stools, 20% of patients had Type 3 stools according to the Bristol Scale. Supplementary nutrition signifi cantly improved gut microbiota profi le.
Conclusion: Long-term gluten-free diet in celiac disease leads to a decrease in dietary fi ber and polysaccharides consumption and promotes intestinal dysbiosis. Functional foods improve symptoms, stool consistency and gut microbiota profi le in adult celiac patients on gluten-free diet.
Keywords: celiac disease, functional foods, gluten-free diet, intestinal dysbiosis, metabolic disorders. Eksperimental’naya i Klinicheskaya Gastroenterologiya 2015; 124 (12): 42–49
Список литературы


